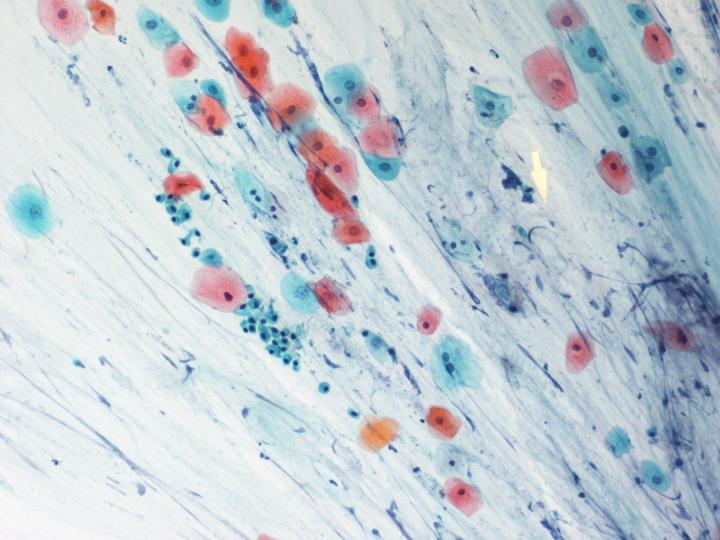
柏氏染色(Papanicolaou stain)
- 染色目的:
細胞的內部細微結構,經過特別的染色化學藥物作用之後,會起化學反應而產生特別顏色,經過染色的細胞其細胞核與細胞質的細微結構,有更清楚的輪廓在顯微鏡下辦認,以幫助作臨床診斷的參考。
- 檢驗方法原理
柏式染色法主要有四個原理:
1.固定
2.核染色
3.細胞質染色
4.透明,這些原理是用不同的溶液來進行水化、脫水和浸潤。核染色:
利用蘇木紫(Hematoxylin)來染核,一般有二種方法,一種是退行性染色法,用蘇木紫(Hematoxylin)來過染,然後用稀釋過的0.5%鹽酸來把超過的染色去除,然後用水把鹽酸沖洗掉,另一種是進行性染色,只染到需要的顏色強度便停止。
酸鹼平衡:利用鹼性的氨水溶液(Ammonia water)來平衡前面步驟使用之鹽酸溶液之酸性。細胞質染色:常用的二種合成染料,第一種是Orange G (OG-6)分子量小,能很快穿透細胞質,會把角質(keratin)染成鮮橘色,第二種是EA50,由伊紅(Eosin)和Light green所組成,伊紅染成熟的扁平細胞、核仁和纖毛,Light green染代謝性強細胞,如深層、中層鱗狀上皮細胞和柱狀上皮細胞染成綠色或藍色。分色:利用1%醋酸溶液(Acetic Acid)及1%磷鉬酸溶液(Phosphotungstic Acid)將Orange G (OG-6)與EA50染在細胞質之顏色區分。固定:以95% Alcohol作固定液,至少30分鐘以上。透明:最常用二甲苯(Xylene),目的是使細胞有透明度以利黎龤A,因二甲苯(Xylene)無色,化學性為惰性,折射率1.494,近似玻片1.515,與酒精和封片用的膠都相容的特性,能使顯微鏡的光源穿過染過色的細胞。染色步驟:
-
Running Water 1分
-
Gill’s Hematoxylin 3分
-
Running Water 30秒
-
0.25% Acid alcohol 10秒
-
Running Water 30 秒
-
Ammonia water 10 秒
-
Running Water 5 分
-
50% Alcohol 10 秒
-
75% Alcohol 10 秒
-
95% Alcohol 10 秒
-
OG-6 4 分
-
95% Alcohol 15 秒
-
95% Alcohol 15 秒
-
1% Acetic Acid 10 秒
-
1% Phosphotungstic Acid 10 秒
-
EA-50 7分30 秒
-
95% Alcohol 30 秒
-
95% Alcohol 30 秒
-
100% Alcohol 1 分
-
100% Alcohol 1 分
-
100% Alcohol 1 分
-
二甲苯 2 分
-
二甲苯 3 分
-
二甲苯 5 分
-
封片
子宮頸抹片之柏氏染色